Introducción
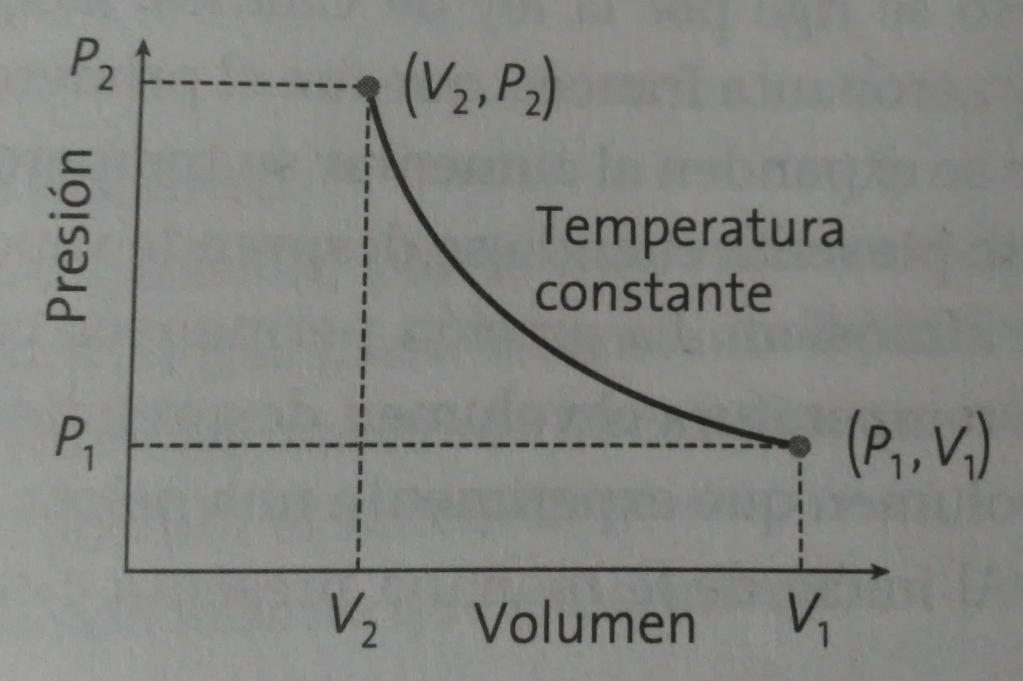
Un proceso isotérmico se presenta cuando la temperatura del sistema, independientemente de los cambios de volumen o presión que sufra, permanece constante. Este proceso se rige por la ley de Boyle-Mariotte: Robert Boyle (1626-1691), físico y químico irlandés muy conocido por sus experimentos acerca de las propiedades de los gases y Edme Mariotte (1620-1684), físico francés, descubrió la ley que relaciona la presión y el volumen de los gases a temperatura constante.
Si un proceso isotérmico formado por un gas experimenta una expansión isotérmica, para que la temperatura permanezca constante la cantidad de calor recibido debe ser igual al trabajo que realiza durante la expansión. Pero si presenta una compresión isotérmica, para que la temperatura también permanezca constante el gas tiene que liberar una cantidad de calor igual al trabajo desarrollado sobre él. Debido a que la temperatura no cambia, su energía interna () permanece constante y su variación de energía interna (
) es igual a cero, por lo que se cumple que: (
es constante) (
)
.
En la figura 1 se muestra la gráfica de un proceso isotérmico. Cualquier punto sobre la isoterma indica un par de valores de volumen y presión, pero todos a la misma temperatura.
Problema resuelto
Problema. Un gas, al expandirse, absorbe 200 calorías realizando un trabajo sobre los alrededores de 840 Joule:
a) Calcular la variación de su energía interna.
b) ¿Qué tipo de sistema termodinámico es?
Solución. Se realiza una conversión de calorías a Joule la cantidad de calor.
Solución a. Calculando la variación de energía interna
Solución b. Analizando el resultado, la variación de energía interna es cero, esto indica que la temperatura se mantuvo constante, por lo que se trata de un proceso isotérmico.