Introducción
Con el tiempo se ha modificado el concepto de átomo, desde considerarlo una esfera sólida indestructible, hasta visualizarlo como nubes electrónicas alrededor del núcleo atómico. Empezar a comprenderlo ha permitido entender y explicar diversos fenómenos, desde la electrización de la materia hasta la física de las partículas de alta energía.
Modelo de Rutherford
En 1911, Ernest Rutherford (1871-1937), físico inglés, premio Nobel (descubrió el núcleo atómico y se dedicó al campo de la desintegración de los elementos), propone su modelo atómico. Había bombardeado laminillas de oro muy delgadas con un haz de partículas alfa y observó que la mayoría de estas partículas atravesaban las laminillas sin sufrir ninguna desviación, otras eran desviadas y las menos rebotaban en sentido contrario. Su explicación fue que la mayor parte de la masa del átomo estaba concentrada en una región muy pequeña, a la que denominó núcleo atómico; que éste contenía una carga positiva, que los electrones giraban a su alrededor y que la mayor parte del átomo era espacio vacío debido a las enormes distancias existentes entre núcleo y electrones.
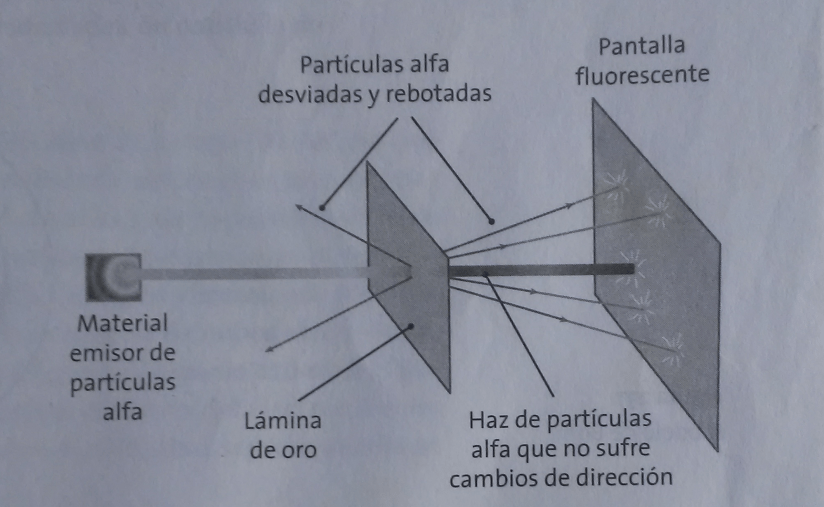
Figura 1. Experimento de Rutherford. 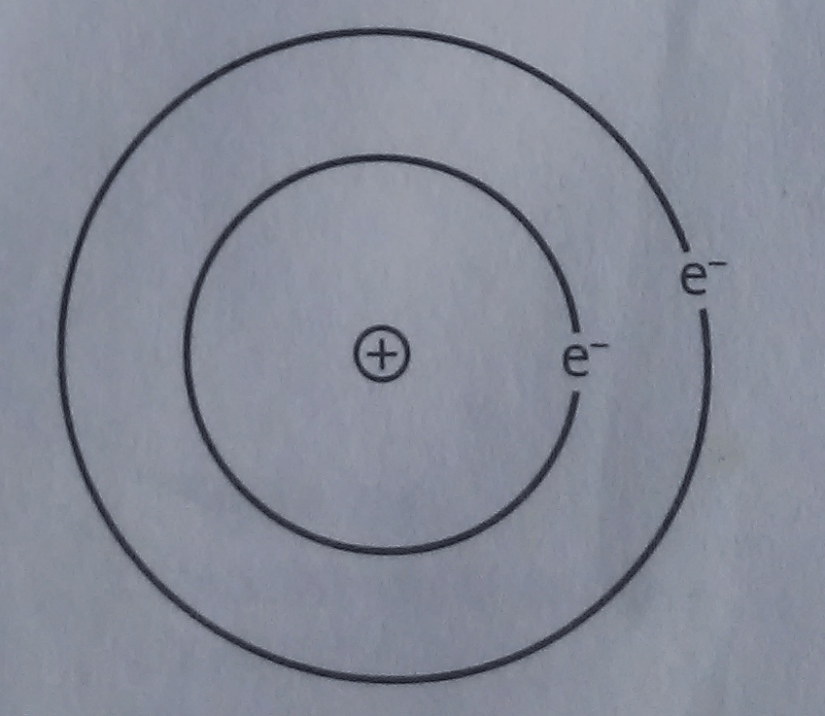
Figura 2. Modelo de Rutherford.
Modelo atómico de Bohr
Niels Bohr (1885-1962), físico danés, premio Nobel por sus investigaciones sobre la estructura de los átomos y la radiación que despiden, propuso en 1913 un modelo que representó un adelanto sobre el de Rutherford. Bohr explicó correctamente el espectro de líneas del átomo de hidrógeno. Sus principales postulados son:
- Los electrones giran alrededor del núcleo en órbitas circulares a gran velocidad y con energía constante.
- Las órbitas están cuantizadas de energía y se representan por números enteros, N=1, N=2, N=3, etcétera.
- Los niveles más cercanos al núcleo son los de menor energía, mientras los más lejanos tienen mayor energía.
- Los electrones giran alrededor del núcleo en ciertas órbitas bien definidas (estados estacionario).
- Los electrones no disipan energía continuamente, sino que lo hacen en forma de paquetes de energía (cuantos o fotones).
- Cada nivel de energía puede contener cierto número de electrones. En el primero, 2, en el segundo, 8, en el tercero, 18, de acuerdo con la regla
, pero en el último no debe haber más de 8.

Modelo de Sommerfeld
Para tratar de aclarar los espectros finos de los elementos, en donde una línea observada resultaba ser en realidad dos o más muy cercanas, Arnold Sommerfeld (1868-1951) propuso una teoría más exacta del origen de los espectros atómicos, que explicaba las propiedades eléctricas y magnéticas de átomos y moléculas. Para completar el modelo de Bohr propuso que:
- Las órbitas podían ser circulares y elípticas.
- En las órbitas elípticas el núcleo debía encontrarse en uno de sus focos.
- En los niveles de energía existían subniveles representados por las letras s, p, d y f.
- El número de orbitales elípticos no deben superar al número cuántico principal, de tal forma que el nivel 1 contiene una órbita circular, el nivel 2 una circular y una elíptica, el nivel 3 una circular y dos elípticas con diferente grado de excentricidad.

Modelo de la mecánica cuántica
En 1926, Edwin Schroedinger (1887-1961), físico alemán, premio Nobel por sus aportaciones a la mecánica cuántica, usando un modelo matemático tridimensional basado en las propiedades ondulatorias del electrón y en la cuantificación de su energía cinética y potencial, desarrolló un conjunto de ecuaciones por medio de las cuales intentó explicar el movimiento del electrón en términos de probabilidades. Imaginó al átomo con un núcleo positivo rodeado de nubes electrónicas, las cuales permiten ubicar al electrón en algún lugar del espacio atómico. La solución de este modelo sobre el comportamiento del electrón fueron tres números cuánticos y uno independiente, cuyo significado y representación se describe a continuación.
| Número cuántico | Nombre | Qué representa |
| Principal | Nivel energético donde puede encontrarse el electrón. | |
| Secundario | Forma que presentan los subniveles (s, p, d y f) (esférica, cacahuates, trébol y moñito). | |
| Magnético | Orientación de los subniveles. | |
| Espín | Giro del electrón sobre sí mismo |
