Introducción
Comprender correctamente el comportamiento y relación que se da entre temperatura, presión y volumen, es fundamental en diversos productos industriales. Por ejemplo, el comportamiento de gases ante estas variables permite elegir los combustibles más idóneos para mejorar el funcionamiento de diversas máquinas térmicas, como el refrigerador. Las sustancias en estado gaseoso se rigen por la primera y segunda ley de la termodinámica y junto con las leyes generales de los gases, hacen eficientes las máquinas térmicas que han contribuido en gran medida al desarrollo industrial, de los primeros barcos y trenes de vapor que permitieron el manejo de productos en grandes volúmenes, hasta los modernos automóviles de combustión interna y transbordadores espaciales.
Termodinámica
Es la rama de la física que se encarga del estudio de la transformación del calor en trabajo mecánico y viceversa. Su base principal es la conservación de energía. Proporciona la teoría básica para entender y diseñar máquinas térmicas, como turbinas de vapor, refrigeradores, cohetes y máquinas de combustión interna.
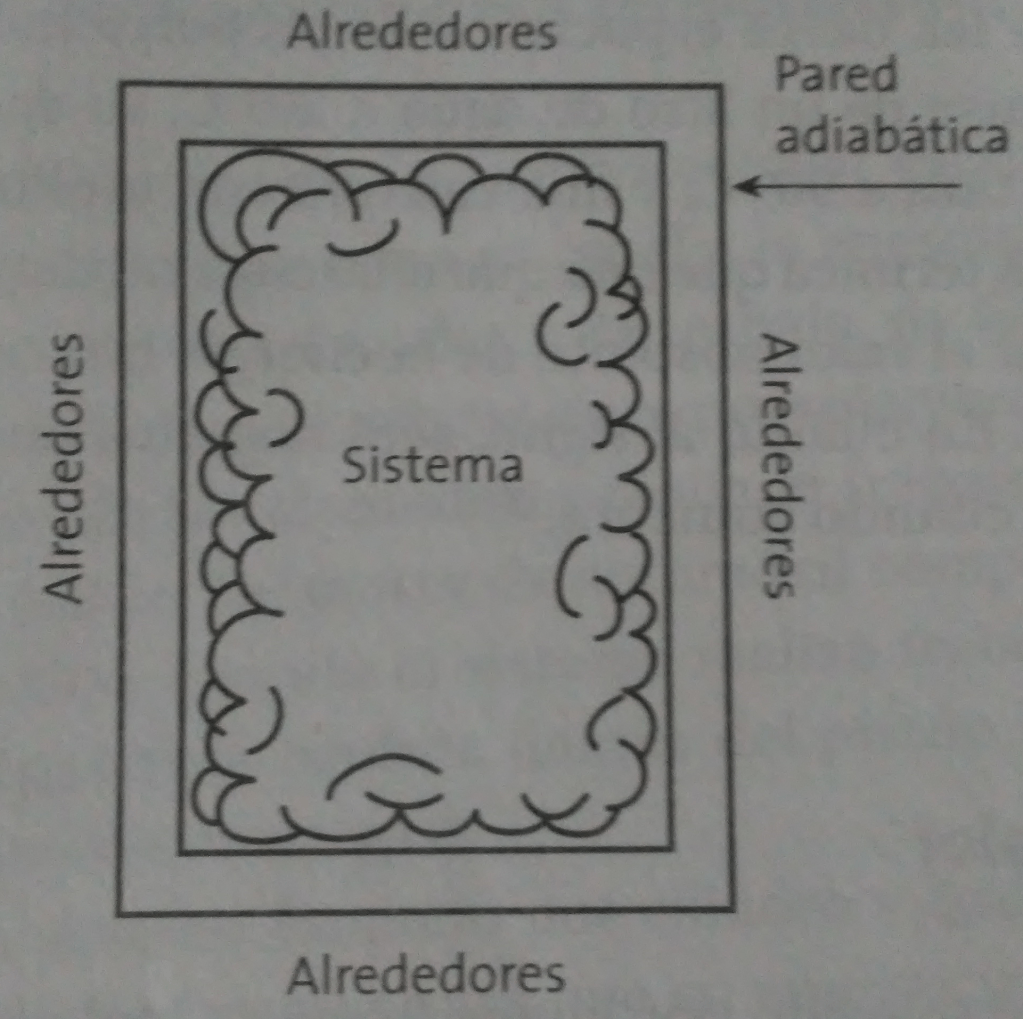
Sistema termodinámico
Es una parte del universo que se separa con la finalidad de poderla estudiar. Para ello se aísla de los alrededores a través de límites o fronteras, de tal manera que todo lo que se encuentra fuera de lo delimitado se denomina alrededores.
Por ejemplo, un sistema puede ser un recipiente cualquiera. En tal caso, se aislará del resto del universo y podrá considerarse que tenga paredes que permitan el intercambio o no de calor.
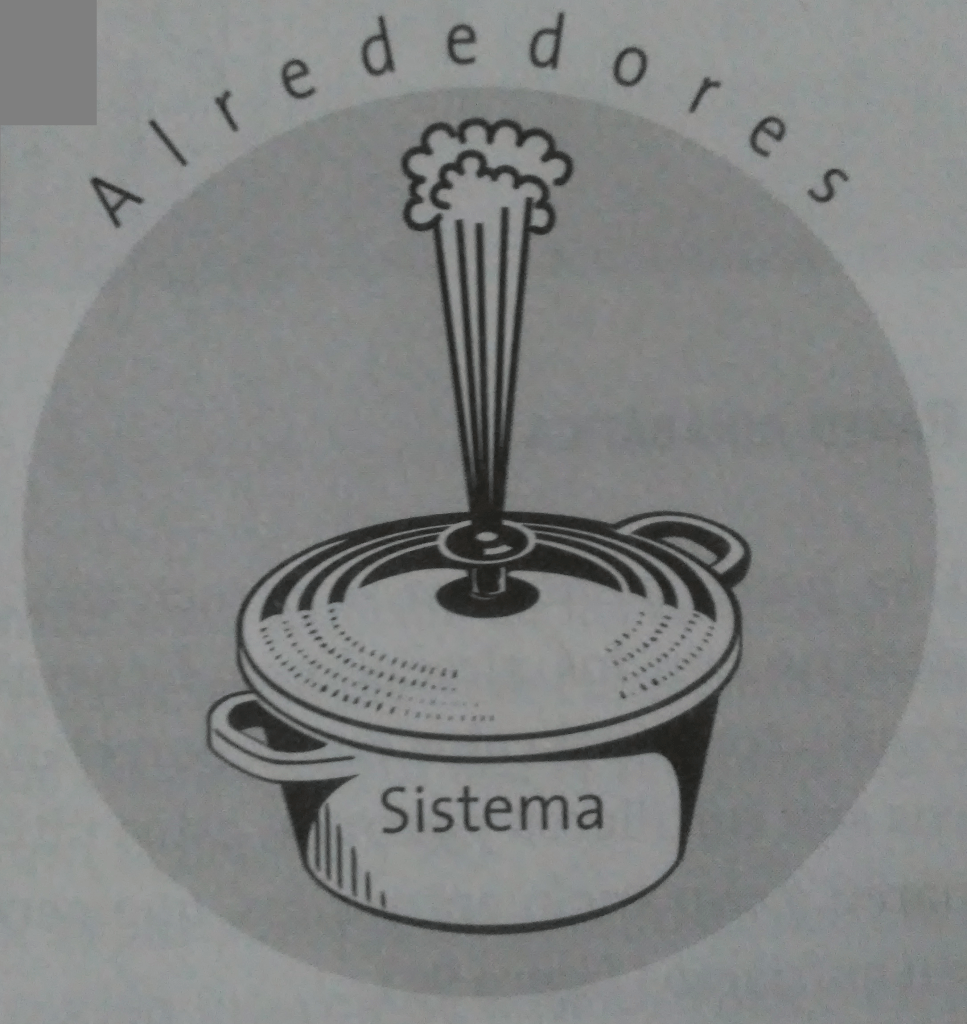
Frontera
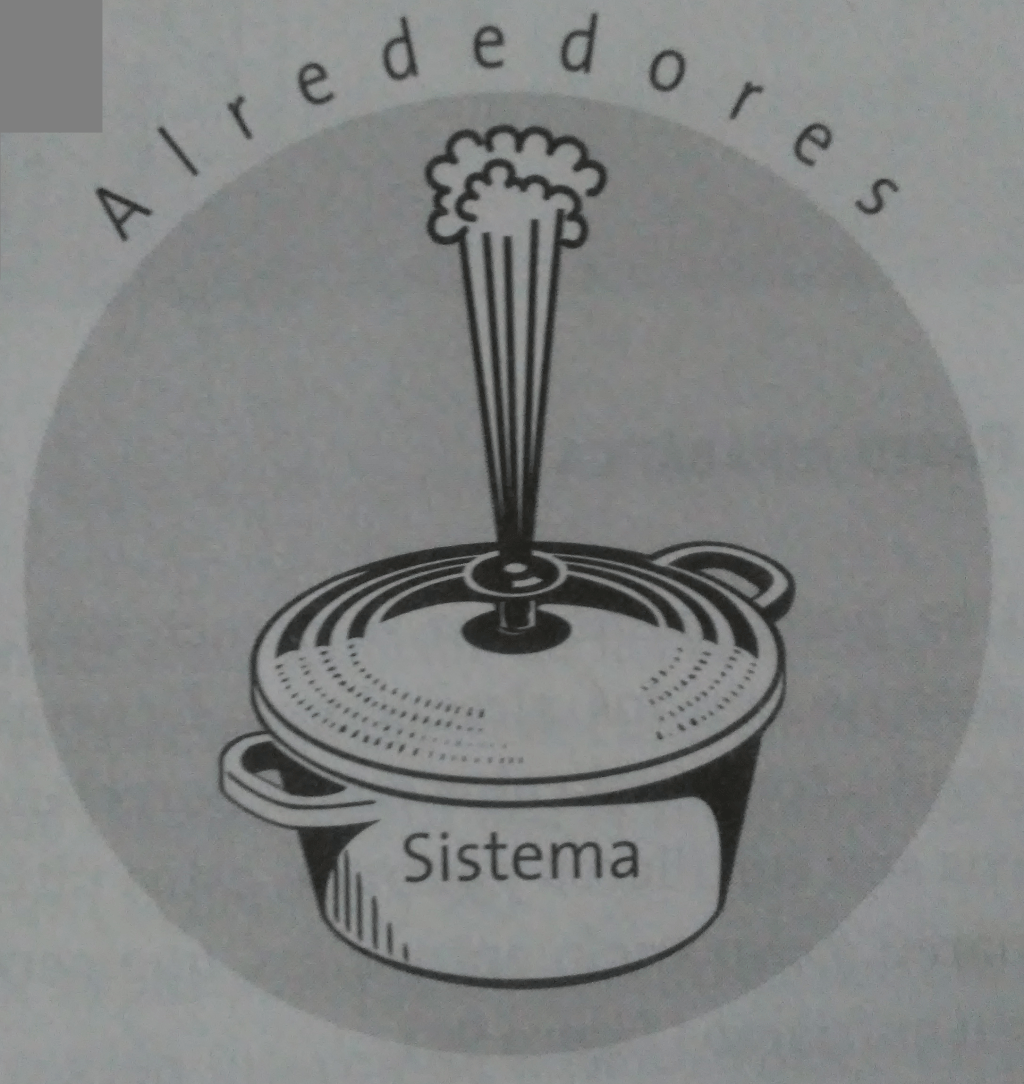
Es el límite que separa al sistema de los alrededores. Generalmente son parees que pueden ser diatérmicas o adiabáticas.
Pared diatérmica
Es una buena conductora de calor. Permite el intercambio de calor entre el sistema y sus alrededores y viceversa.


Pared adiabática
Se caracteriza por no permitir la interacción térmica del sistema con los alrededores. Generalmente se construyen de materiales malos conductores de calor como porcelana y asbesto.

Equilibrio termodinámico
Se alcanza cuando después de cierto tiempo de poner en contacto un sistema a baja temperatura con otro sistema a mayor temperatura se igualan, por lo que no hay intercambio de calor. En este punto las propiedades como presión, densidad, temperatura, ya no varían.

Energía interna
La energía interna () es la energía contenida en el interior de las sustancias. Se define como la suma de energía cinética y potencial de las moléculas individuales que la forman. Generalmente se cumple cuanto mayor sea la temperatura de un sistema también lo será su energía interna.
La energía interna se hace presente en las sustancias combustibles como la gasolina, utilizada en motores de combustión interna de automóviles o en las sustancias usadas en la propulsión de las naves espaciales. Es proporcional a la masa.
Debido a que no se puede determinar el valor absoluto de la energía interna, se cuantifica la variación que sufre, (). En cuanto al signo, será negativo cuando disminuye dentro del sistema y positivo cuando aumenta.