Introducción
Un gas experimenta un proceso termodinámico cuando varía su presión, volumen o temperatura. Los procesos termodinámicos se clasifican en isotérmicos, isobáricos, isocóricos y adiabáticos.
A continuación se muestran las condiciones que se cumplen para los cuatro procesos termodinámicos descritos hace un momento.
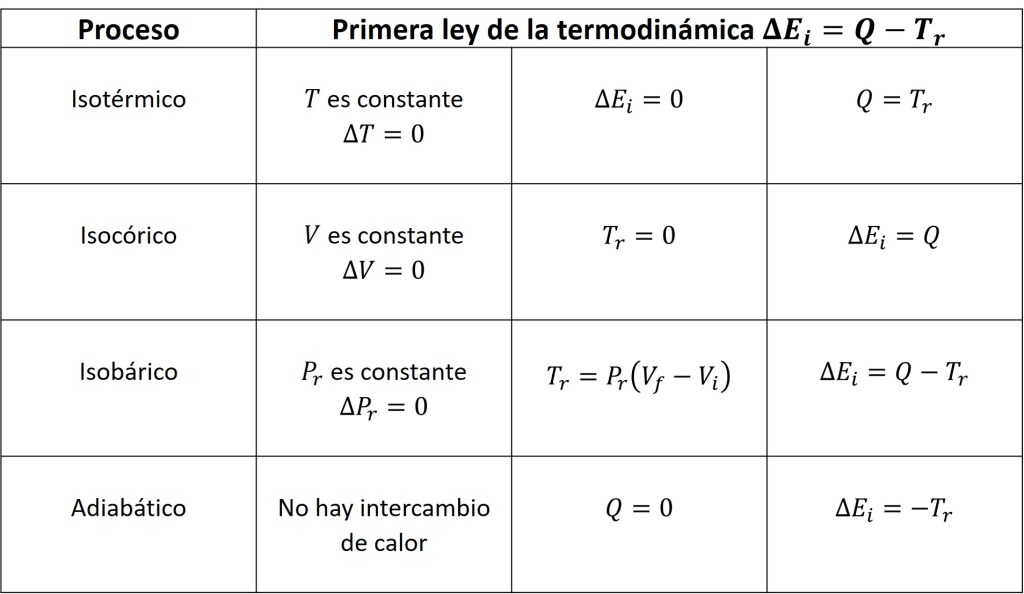
Proceso istotérmico
Un proceso isotérmico se presenta cuando la temperatura del sistema, independientemente de los cambios de volumen o presión que sufra, permanece constante. Este proceso se rige por la ley de Boyle-Mariotte: Robert Boyle (1626-1691), físico y químico irlandés muy conocido por sus experimentos acerca de las propiedades de los gases y Edme Mariotte (1620-1684), físico francés, descubrió la ley que relaciona la presión y el volumen de los gases a temperatura constante.
Proceso isobárico
Es un proceso isobárico cuando hay una variación de temperatura o de volumen y la presión permanece, no importando si el gas sufre una compresión o una expansión. Este proceso se rige por la ley de Charles: Jacques A. Charles (1742-1822), químico, físico y aeronauta francés, que fue el primero en hacer mediciones acerca de los gases que se expanden al aumentar su temperatura. Un ejemplo cotidiano de este proceso se presenta cuando se desprende vapor al hervir agua en un recipiente abierto a la atmósfera. La presión permanece constante, de forma tal que entre mayor sea la temperatura el volumen desprendido aumenta.
Proceso isocórico
Un proceso isocórico o isovolumétrico se presenta cuando el volumen del sistema permanece constante. Debido a que la variación de volumen es cero, no se realiza trabajo ni sobre el sistema no de este último sobre los alrededores, por lo que se cumple que y
. En general, se presenta cuando un gas se calienta dentro de un recipiente con volumen fijo. Debido a este comportamiento, los aerosoles contenidos en recipientes traen la leyenda «no exponer al fuego», ya que de hacerlo, la temperatura y la presión interna aumentan significativamente y puede originarse una explosión del recipiente.
Proceso adiabático
Ocurre un proceso adiabático cuando el sistema no cede no recibe calor, cumpliéndose que y
, aun cuando el gas puede presentar expansión o compresión.